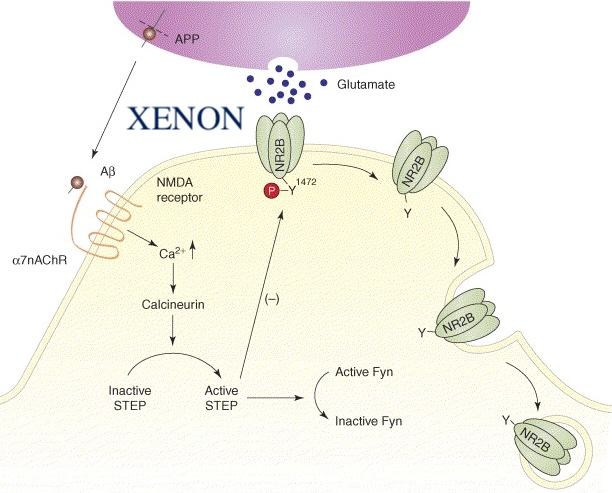
Ишемический инсульт возникает в результате тромботической или эмболической блокады мозговых артерий, что приводит к ограничению кровотока в пораженной мозговой ткани с последующим истощением энергии. Это вызывает ряд сложных патофизиологических событий, включая нарушение ионного гомеостаза, накопление синаптического и экстрасинаптического глутамата, нарушение функции ионных каналов, повреждение мембран и ДНК, воспаление и так далее, в конечном итоге приводящих к ишемическому повреждению головного мозга и гибели нейронов.
Во время внутримозгового кровоизлияния происходит накопление крови в паренхиме головного мозга, что приводит к повреждению анатомических структур и повышению местного давления. Первичное повреждение мозговой ткани происходит в течение нескольких минут или часов и является главным образом результатом механического воздействия на ткани, связанного с масс-эффектом. Вторичное повреждение может быть реализовано через множество патологических механизмов. К ним относятся цитотоксичность крови, гиперметаболизм, эксайтотоксичность, окислительный стресс и воспаление.
Нейропротекторный эффект ксенона
Нейропротекторный эффект ксенона при этих состояниях может иметь хорошие перспективы, поскольку согласно современным представлениям, при всех видах ишемического или геморрагического инсульта либо субарахноидального кровоизлияния в конечном итоге наблюдаются общие патогенетические механизмы гибели нейронов.
В модели ишемического инсульта in vivo путем введения аутологичного сгустка крови внутрипросветным методом с последующей ингаляцией ксенона во время ишемии и в постишемическом периоде показаны отчетливые нейропротективные свойства ксенона.
Кроме того, in vitro выявлено, что ксенон может изменять каталитическую эффективность тканевого активатора плазминогена (tPA). В этом исследовании установлено, что ксенон является ингибитором tPA; ксенон, который был использован во время ишемии, дозозависимо ингибирует tPA-индуцированный тромболизис и последующее уменьшение ишемического повреждения головного мозга; ингаляция ксенона после ишемии фактически подавляет ишемическое повреждение головного мозга и tPA-индуцированные кровоизлияния в мозг, а также разрушение гемато-энцефалического барьера. Взятые вместе, эти данные показывают, что ксенон не следует вводить до или в процессе терапии tPA; ксенон, возможно, может быть использован для лечения острого ишемического инсульта, если он применяется после tPA-индуцированной реперфузии.
Воздействие ксеноном после транзиторной ишемии у крыс приводит к уменьшению объема инфаркта мозга в зависимости от концентрации, времени экспозиции и улучшению неврологической функции через 7 суток после ишемического события. Хотя ксенон не улучшал неврологическую оценку через 28 суток после ишемии, однако его сочетание с легкой гипотермией улучшает неврологический исход, а сочетание его ингаляции с гипотермией улучшает исход при внутримозговом кровоизлиянии.
В последнее время появились интересные экспериментальные работы по изучению защитных свойств ксенона при субарахноидальном кровоизлиянии. Особый интерес вызывают данные в исследовании M. Veldeman et al. (2017), полученные на моделях субарахноидального кровоизлияния у крыс. У животных, получавших 50 об.% ксенона в течение 1 часа после субарахноидального кровоизлияния, отмечалось менее выраженное повреждение нейронов ипсилатеральных областей гиппокампа (область CA3) и зубчатой извилины по сравнению с контрольной группой. У животных, получавших ксенон, наблюдалось меньшее количество клеток микроглии, что свидетельствует об иммуномодулирующем эффекте, создаваемом ксеноном.
В работе Y.F. Miao et al. (2018) на модели САК у грызунов проведено интересное исследование по доставке ксенона в очаг повреждения ксенон-содержащими эхогенными липосомами (Xe-ELIP) посредством контролируемого ультразвуком высвобождения. Препарат вводили внутривенно в сочетании с ультразвуковым воздействием на общую сонную артерию, чтобы вызвать высвобождение ксенона из циркулирующих Xe-ELIP. В исследовании показано уменьшение апоптотической гибели нейронов и объема кровотечения. Авторы отмечают улучшение неврологической оцен- ки, уменьшение выраженности моторной дисфункции и снижение летальности в группе, получавшей лечение Xe-ELIP в сравнении с контрольной.
В исследовании Гребенчикова О.А. (2024) было показано, что ингаляция ксенона в концентрации 0,25 МАК при экспозиции 60 мин после моделирования открытой ЧМТ у крыс значимо уменьшает объем поражения головного мозга на 14-е сут посттравматического периода. Данная концентрация уменьшает неврологический дефицит на 7- и 14-е сутки. Увеличение концентрации ксенона в газовой смеси до 0,5 МАК не усиливает его нейропротекторные свойства на головной мозг крыс.
Можно предположить, что в клинической практике нейропротективный эффект ксенона при ЧМТ будет полезен в субанестетических концентрациях (0,25–0,5 МАК). Это позволит не только избежать критических инцидентов в отделениях реанимации, в частности угнетения сознания у пациентов с исходно тяжелой церебральной недостаточностью, но и добиться положительного эффекта при минимальных финансовых затратах, учитывая стоимость ксенона.